1. DENOMINAZIONE DEL MEDICINALE
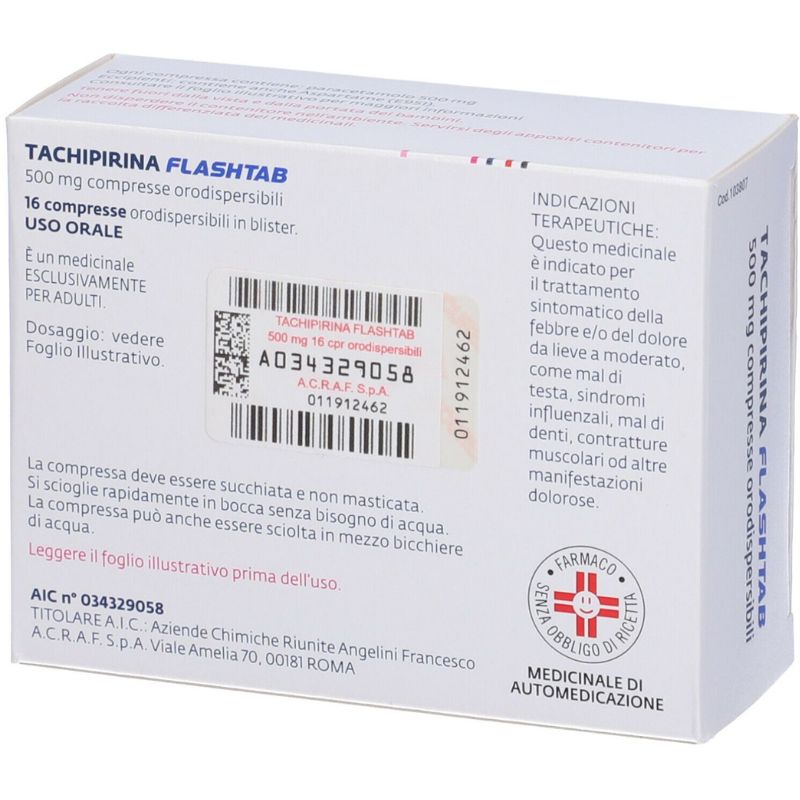
TACHIPIRINA FLASHTAB 500 mg Compresse orodispersibili.
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Ogni compressa orodispersibile contiene paracetamolo 500 mg (come cristalli di paracetamolo rivestiti).
Eccipienti con effetti noti: ogni compressa contiene anche 40 mg di aspartame (E951).
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA:
Compressa orodispersibile.
Compressa bianca, rotonda, bi-convessa con concavità centrale ed un caratteristico aroma di ribes.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Trattamento sintomatico del dolore da lieve a moderato e/o della febbre.
4.2 Controindicazioni
– Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
– Fenilchetonuria (per la presenza di aspartame).
– Grave insufficienza epatocellulare.
4.3 Avvertenze speciali e precauzioni d’impiego
Avvertenze
Non superare la dose raccomandata.
L’uso prolungato del prodotto, all’infuori del controllo medico, può essere dannoso.
Questo prodotto deve essere usato solo se strettamente necessario.
Dosi superiori a quelle raccomandate comportano un rischio di danni epatici molto gravi.
Deve essere effettuato prima possibile un trattamento con un antidoto. Vedere paragrafo 4.9.
Per evitare il rischio di sovradosaggio, avvisare i pazienti di evitare l’uso contemporaneo di altri medicinali contenenti paracetamolo.
Questo medicinale contiene aspartame, una fonte di fenilalanina, equivalente a 0,2 mg per compressa e, perciò, è controindicato nei soggetti affetti da fenilchetonuria (vedere paragrafo 4.3).
Precauzioni per l’uso
Il paracetamolo deve essere usato con cautela in caso di:
– Adulti di peso inferiore ai 50 Kg
– Insufficienza epatocellulare da lieve a moderata (nota: il paracetamolo è controindicato in casi di grave insufficienza epatocellulare)
– Alcoolismo cronico
– Malnutrizione cronica (basse riserve di glutatione epatico)
– Disidratazione
– Grave insufficienza renale (clearance della creatinina 10 ml/min – vedere paragrafo 4.2).
In caso di febbre alta, o di segni di infezione secondaria, o di persistenza di sintomi oltre i 3 giorni, deve essere effettuata una rivalutazione del trattamento.
Durante un trattamento prolungato con farmaci analgesici, effettuato con dosi superiori a quelle previste nel foglio illustrativo, può presentarsi cefalea che non deve essere trattata con dosi più elevate del medicinale.
In generale, l’uso abituale di analgesici, in particolar modo la combinazione di differenti farmaci analgesici, può comportare lesioni renali permanenti con il rischio di insufficienza renale (nefropatia da analgesici). In caso questa situazione si manifesti o se ne sospetti l’insorgenza, occorre consultare il medico ed interrompere il trattamento.
La diagnosi di “cefalea da abuso di analgesici” deve essere presa in considerazione in quei pazienti che soffrono di cefalee frequenti o giornaliere nonostante (o per) l’uso regolare di farmaci per le cefalee.
4.4 Interazioni con altri medicinali ed altre forme di interazione
Il probenecid causa una riduzione di almeno 2 volte della clearance del paracetamolo attraverso l’inibizione della sua coniugazione con l’acido glucuronico. In caso di trattamento concomitante con probenecid si deve considerare una riduzione del
dosaggio del paracetamolo.
La salicilamide può prolungare l’emivita di eliminazione del paracetamolo.
Paracetamolo si deve usare con cautela in caso di assunzione concomitante di induttori enzimatici (quali carbamazepina, fenobarbitale, fenitoina, primidone, rifampicina, Iperico o Erba di San Giovanni) o di sostanze potenzialmente epatotossiche (vedere paragrafo 4.9).
Metoclopramide e domperidone: accelerano l’assorbimento del paracetamolo
Colestiramina: riduce l’assorbimento del paracetamolo.
L’uso concomitante di paracetamolo (4 g al giorno per almeno 4 giorni) con anticoagulanti orali può indurre leggere variazioni nei valori di INR con conseguente aumento del rischio di sanguinamento. In questi casi deve essere condotto un monitoraggio più frequente dei valori di INR durante l’uso concomitante e dopo la sua interruzione.
Interazioni con i test clinici:
La somministrazione di paracetamolo può alterare il dosaggio dell’acido urico nel sangue, ottenuto con il metodo all’acido fosfotungstico, ed il dosaggio della glicemia ottenuto con il metodo della ossidasi-perossidasi del glucosio.
4.5 Fertilità, gravidanza e allattamento Gravidanza
Dati epidemiologici sull’uso di dosi orali terapeutiche di paracetamolo non mostrano effetti indesiderati sulla gravidanza o sulla salute del feto/neonato. Dati prospettici su gravidanze esposte a sovradosaggi non hanno evidenziato un incremento nel rischio di
malformazioni. Studi sulla riproduzione eseguiti con somministrazione per via orale non hanno mostrato alcuna malformazione o effetti feto-tossici.
Di conseguenza, in condizioni d’uso normali, il paracetamolo può essere usato nel corso della gravidanza dopo una valutazione del rapporto rischio-beneficio.
Durante la gravidanza, il paracetamolo non deve essere assunto per lunghi periodi, a dosi elevate o in associazione con altri medicinali, dal momento che la sicurezza d’uso in questi casi non è stata stabilita.
Allattamento
Dopo somministrazione orale, il paracetamolo viene escreto nel latte materno in piccole quantità. Non sono stati riportati effetti indesiderati sui bambini allattati al seno. Dosi terapeutiche di questo medicinale possono essere assunte durante l’allattamento.
4.6 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Non pertinente.
4.7 Effetti indesiderati
Classificazione sistemica organica:
Rari (da 1/10.000 a <1/1.000)
Molto rari (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- Patologie epatobiliari : Rari : aumento dei livelli di transaminasi epatiche
- Disturbi del sistemai mmunitario: Molto rari: reazione di ipersensibilità (dalla semplice eruzione cutanea o orticaria, fino allo shock anafilattico richiedente l’interruzione del trattamento)
- Patologie del sistema emolinfopoietico: Molto rari: trombocitopenia, leucopenia, neutropenia (segnalazioni sporadiche)
- Patologie della cute e del tessuto sottocutaneo: Molto rari: Sono stati segnalati casi molto rari di reazioni cutanee gravi.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all’indirizzo
www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
4.8 Sovradosaggio
Vi è un rischio di danno epatico (che include epatite fulminante, insufficienza epatica, epatite colestatica, citolisi epatica), in particolare in soggetti anziani, in bambini piccoli, in pazienti con malattie epatiche, in caso di alcoolismo cronico, in pazienti con malnutrizione cronica e in pazienti che ricevono induttori enzimatici. In questi casi, il sovradosaggio può essere fatale.
I sintomi generalmente compaiono nelle prime 24 ore e comprendono: nausea, vomito, anoressia, pallore e dolore addominale.
Il sovradosaggio, 7,5 g o più di paracetamolo in una singola somministrazione nell’adulto o 140 mg/kg di peso corporeo in una singola somministrazione nel bambino, causa necrosi degli epatociti che rende probabile l’induzione di una necrosi completa ed
irreversibile, che comporta insufficienza epatocellulare, acidosi metabolica ed encefalopatia le quali possono condurre al coma ed alla morte. Contemporaneamente si osserva un incremento nei livelli di transaminasi epatiche (AST, ALT), latticodeidrogenasi e bilirubina, insieme con aumento del tempo di protrombina che può comparire da 12 a 48 ore dopo la somministrazione. I sintomi clinici di danneggiamento epatico compaiono di solito dopo due giorni e raggiungono un massimo dopo 4 – 6 giorni.
Si può sviluppare insufficienza renale acuta con necrosi tubulare acuta anche in assenza di grave danneggiamento epatico. Altri sintomi non epatici che sono stati riportati a seguito di sovradosaggio del paracetamolo includono anomalie miocardiche e
pancreatiti.
Comportamento d’emergenza
trasferimento immediato in ospedale anche se non ci sono sintomi precoci significativi
prelievo di un campione di sangue per un dosaggio iniziale della concentrazione di paracetamolo plasmatico
lavanda gastrica
somministrazione per via endovenosa (od orale se possibile) dell’antidoto Nacetilcisteina possibilmente prima di dieci ore dall’ingestione. L’ N-acetilcisteina può fornire, tuttavia, un certo grado di protezione anche dopo 10 ore, e fino a 48 ore, ma in
questi casi viene eseguito un trattamento prolungato.
deve essere effettuato un trattamento sintomatico.
la metionina per via orale può essere usata come alternativa all’N-acetilcisteina purchè sia somministrata prima possibile dopo il sovradosaggio e, in ogni caso, entro 10 ore dallo stesso.
5. PROPRIETA’ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: analgesici ed antipiretici, anilidi.
Codice ATC: N02BE01
Il meccanismo preciso dell’effetto analgesico ed antipiretico del paracetamolo deve essere ancora stabilito; esso può coinvolgere azioni centrali e periferiche.
5.2 Proprietà farmacocinetiche
Assorbimento
L’assorbimento del paracetamolo per via orale è completo e rapido. Le massime concentrazioni nel plasma sono raggiunte tra 30 e 60 minuti dopo l’ingestione.
Distribuzione
Il paracetamolo si distribuisce rapidamente in tutti i tessuti. Le concentrazioni nel sangue, nella saliva e nel plasma sono paragonabili tra loro. Il legame con le proteine plasmatiche è debole.
Biotrasformazione
Il paracetamolo è metabolizzato principalmente nel fegato. Due le vie metaboliche principali: coniugazione con acido glucuronico e solfo-coniugazione. Quest’ultima via è saturabile rapidamente a dosi superiori alle dosi terapeutiche. Una via minore, catalizzata dal citocromo P450 (in particolare CYP2E1), conduce alla formazione di un intermedio reattivo, l’N-acetil-p-benzochinoneimina, che, in normali condizioni d’impiego, è rapidamente detossificata dal glutatione ed eliminata nelle urine dopo coniugazione con la cisteina e l’acido mercapturico. Al contrario, durante le intossicazioni gravi, la quantità di questo metabolita tossico è aumentata.
Eliminazione
Essa è essenzialmente urinaria. Il 90% della dose ingerita è eliminata dai reni in 24 ore, soprattutto come glucuronide (da 60 a 80%) e come solfoconiugati (da 20 a 30%). Meno del 5% viene eliminato in forma immutata.
L’emivita di eliminazione è di circa 2 ore.
Insufficienza renale
In caso di grave insufficienza renale (clearance della creatinina di meno di 10 ml/min) l’eliminazione del paracetamolo e dei suoi metaboliti è ritardata.
Soggetti anziani: la capacità di coniugazione rimane la stessa.
5.3 Dati preclinici di sicurezza
Negli esperimenti su animali, riguardanti la tossicità acuta, subcronica e cronica del paracetamolo nei ratti e nei topi, sono state osservate lesioni gastro-intestinali, variazioni nell’ematocrito, degenerazione del parenchima epatico e renale ed anche necrosi. Le cause di questi cambiamenti vengono attribuite, da una parte, al meccanismo d’azione, e dall’altra, al metabolismo del paracetamolo. Sono stati riscontrati anche nell’uomo i metaboliti che si presume conducano agli effetti tossici e alle corrispondenti alterazioni degli organi. Inoltre, sono stati descritti, durante l’uso prolungato (cioè un anno), all’interno dell’intervallo delle dosi terapeutiche massime, casi molto rari di epatite cronica aggressiva reversibile. In caso di dosi subtossiche, si possono presentare segni di intossicazione dopo tre settimane di assunzione. Il paracetamolo, pertanto, non deve essere assunto per un lungo periodo di tempo e alle dosi più elevate.
Ricerche approfondite non hanno evidenziato a dosi terapeutiche, cioè non tossiche, un rischio genotossico del paracetamolo.
Studi a lungo termine nei ratti e nei topi non hanno evidenziato effetti cancerogeni del paracetamolo a dosi non epatotossiche.
Il paracetamolo attraversa la placenta.
Studi condotti sugli animali ed esperienze nell’uomo, ad oggi, non hanno evidenziato tossicità riproduttiva.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Cristalli di paracetamolo rivestiti:
Copolimero metacrilato butilato basico
Dispersione di poliacrilati al 30%
Silice, idrofoba colloidale
Compressa:
Mannitolo (granuli, polvere)
crospovidone
aspartame (E951)
aroma di ribes
magnesio stearato
6.2 Incompatibilità
Non pertinente.
6.3 Periodo di validità
4 anni
6.4 Precauzioni particolari per la conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.